Regulación de la actividad enzimática
La totalidad de reacciones bioquímicas de un organismo constituye su metabolismo, el cual consiste en secuencias de reacciones químicas catalizadas por enzimas llamadas vías metabólicas. En estas secuencias, el producto de una reacción química es el sustrato de la siguiente reacción y así sucesivamente, tal como lo muestra el siguiente esquema.

Las vías metabólicas son de dos tipos
a) anabólicas: en ellas se sintetizan moléculas básicas que hacen posible construir macromoléculas, son reacciones endergónicas (consumen energía).
b) catabólicas: en ellas se rompen moléculas que permiten obtener energía libre utilizable, son reacciones exergónicas (liberan energía).
Las células y el organismo, deben regular todas sus vías metabólicas constantemente, esto por la gran necesidad de mantener estables sus condiciones internas, es decir, su homeostasis.
En la regulación de la actividad enzimática participan sustancias que actúan como inhibidores, los cuales reducen la velocidad de las reacciones catalizadas. Hay inhibidores naturales que regulan el metabolismo y otros artificiales que permiten tratar enfermedades o eliminar bacterias patógenas. Los inhibidores se clasifican como irreversibles y reversibles.
Inhibidores irreversibles
Son, generalmente, obtenidos por síntesis orgánica y se unen covalentemente al sitio activo de la enzima y con ello la inactivan.
Un buen ejemplo lo constituye el inhibidor artificial DIPF (dilsopropil fósforofluoridano), que inhibe a la tripsina, enzima pancreática que hidroliza proteínas y a la colinesterasa, enzima que degrada al neurotransmisor acetilcolina en el lecho sináptico, una vez que ésta ha cumplido su función.
Por esta razón es parte de los gases neurotóxicos, como la sarina, gas utilizado en el metro de Tokio en 1995, que mató a decenas de personas.
Inhibidores reversibles
Se reconocen dos tipos:
1. Inhibición competitiva
2. Inhibición no competitiva
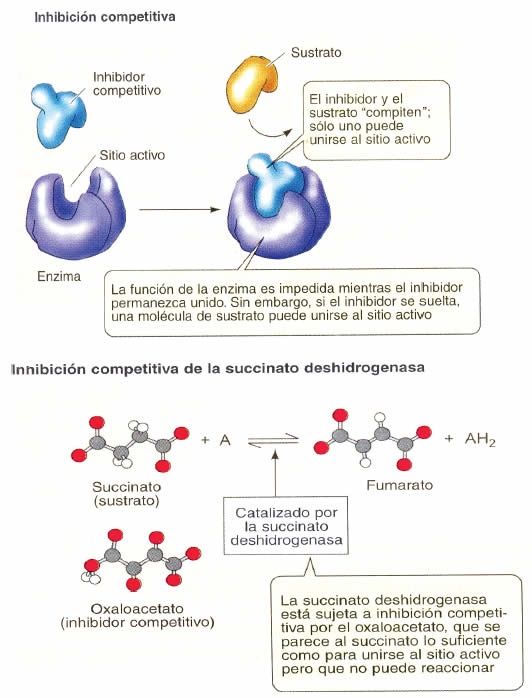
En la inhibición competitiva un sustrato muy parecido al sustrato natural compite con éste por el mismo sitio activo de la enzima. La unión del “impostor” con la enzima no implica formación de nuevos productos, pero impide que esta actúe sobre su sustrato natural. El sustrato “impostor” es desplazado al aumentar la concentración del sustrato natural. En la figura 13 se presenta la inhibición competitiva y como ejemplo la que presenta la enzima succinato deshidrogenasa sometida a una inhibición competitiva por el oxalacetato.
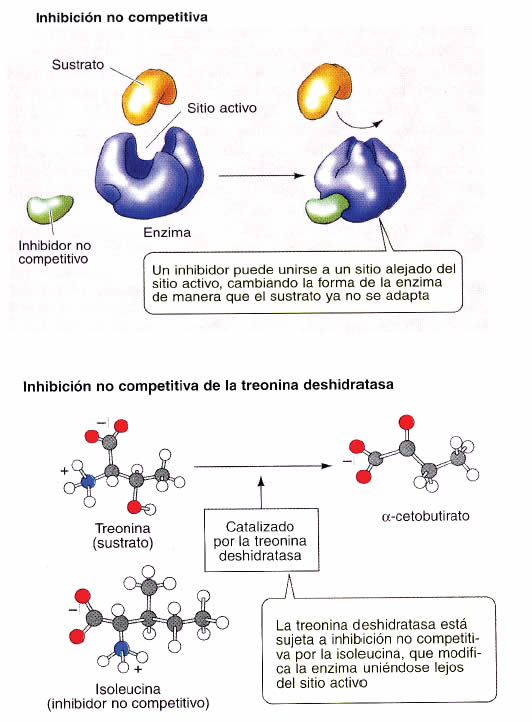
En cambio en la inhibición no competitiva el inhibidor no se une al sitio activo de la enzima, sino que se une a un sitio alejado de este, provocándole un cambio conformacional de manera que el sustrato ya no se adapta. Al igual que en la inhibición competitiva, la enzima se libera del inhibidor y, por ello, es reversible. En la figura 14 se presenta la inhibición no competitiva y como ejemplo la de la enzima treonina deshidratasa por la isoleucina.
Inhibidores alostéricos
Las enzimas alostéricas, por lo general, poseen una estructura de dos o más unidades polipeptídicas y su actividad está controlada por efectores que se unen un sitio alostérico que está separado del sitio activo.
Los efectores pueden ser activadores o inhibidores. A continuación se revisará el tipo de regulación alostérica denominada: inhibición por el producto final.
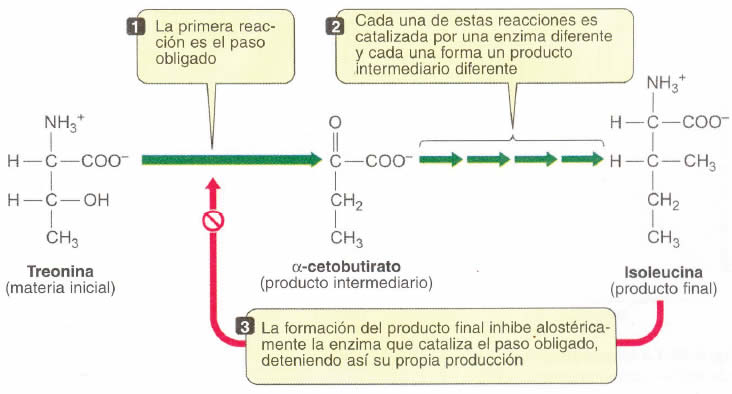
En una vía metabólica, como en el ejemplo de la figura 15, se observa una secuencia de reacciones, cada una de ellas catalizada por una enzima particular.
La primera reacción se denomina “paso obligado”, porque una vez que ocurre, necesariamente seguirán el resto de reacciones de la vía hasta culminar con el producto final. Este “paso obligado” está catalizado por una enzima alostérica. Si la célula tiene suficiente de este producto, ¿cómo frena esta vía? Cuando el producto final está en altas concentraciones actúa como un efector, se une a la enzima alostérica del “paso obligado”, inactivándola.